

推荐语
如果你关心人工智能什么时候可以研发出可以治愈所有疾病的药物?AI如何重塑了新药研发的过程?生物化学领域的“GPT-3时刻”何时到来?那么这场红杉资本合伙人Stephanie Zhan 和Max Jaderberg(DeepMind旗下 Isomorphic Labs 的首席 AI 官)的对话不容错过。
Max Jaderberg将强化学习的发展史与AI在生物化学领域的最新进展紧密串联,系统的阐述了他作为站在AI和生物化学交叉的最前沿的科学家( Isomorphic Labs的CEO因开发 AlphaFold 2 并解决蛋白质结构预测问题获得了2024年的诺贝尔化学奖),如何看待过去十年AI从“游戏实验室”到“攻克生命科学终极难题”背后的科学逻辑,以及真正走向生物化学领域的GPT3时刻的路上还需要面临的挑战。 无论你是计算机科学、生命科学的研究者,还是关注产业变革的决策者,这次播客内容都将带你进入AI赋能新药发现的最前沿,并体会人类与机器共同探索全新知识版图的激动人心。
目录 AlphaFold 3与人工智能药物设计 突破 强化学习的突破:从游戏开始 多人和多智能体参与的游戏 从“玩具”到实际应用 能解决所有疾病的通用药物设计引 擎 如何去实现药物研发的彻底变革 建立生物化学世界模型和找到药物 的智能体 “分子-蛋白”互作与药物研发流程 的质变 AI如何正在重塑药物设计和开发流 程 生物化学领域的GPT3时刻
01. AlphaFold 3与人工智能药物设计的颠覆性突破

Stephanie Zhan: 今天我们非常高兴欢迎 Max Jaderberg 做客本节目,他是 Isomorphic Labs 的首席 AI 官。Isomorphic Labs 源自 DeepMind,目标是用 AI 彻底革新药物发现领域。去年夏天,他们发布了 AlphaFold 3,这是一项令人惊叹的突破,不仅可以建模蛋白质的结构,还能预测所有分子以及它们之间的相互作用。这让 Demis Hassabis(Isomorphic Labs CEO) 去年获得了诺贝尔化学奖。 AlphaFold 3 的发布和 Demis 获得诺贝尔化学奖,时机真是绝佳。这确实是对你和你的团队在过去几年所取得成就的最好证明。 Max Jaderberg: 2024 年对我们来说无疑是非常忙碌的一年,取得了许多重大突破。看到诺贝尔奖的到来,真的令人难以置信,这项开创性工作的成就得到了如此惊人的认可。 Stephanie Zhan: 我想先聊聊你的个人经历。你在深度学习领域从一开始就有着令人瞩目的职业生涯,在 DeepMind 期间发表了许多开创性的论文,包括关于 Capture the Flag 和 Alpha Star,在深度学习领域取得了突破。你能否讲讲,在你进行深度强化学习研究时,心中思考过的一些关键科学问题?
02. 强化学习的突破:从游戏开始
Max Jaderberg: 在 DeepMind,我参与了很多项目。最早是计算机视觉和深度生成模型,但真正让我着迷的是强化学习。那时,DeepMind 是全世界做强化学习的最佳地方。我们心里一直有一个问题:我们如何才能真正让 AI 达到这样的程度——也就是你想让它做什么任务都能做好?当时的主流范式是监督学习,而监督学习和强化学习非常不同,两者虽然都是学习方法,但在监督学习中,你必须知道你所提问题的答案,通过这些答案来训练模型。 在监督学习中,你给模型一个例子,同时把问题的答案也告诉它。如果你已经对你让 AI 解决的问题了解得非常透彻,这样做当然没问题,但大多数时候我们并不了解。世界上有很多问题,我们根本就不知道答案和解决办法。 我们能否把 AI 应用于人类尚未掌握或人类能力有限的领域?这时,强化学习就是一个关键工具。因为强化学习的优势在于:你无需知道答案是什么,你只需要能够判断模型给出的答案是“好”还是“不好”,或者能量化“多好”或“多不好”。 所以,这为模型训练打开了一片全新的问题空间。强化学习真正起步的重大突破,是 DeepMind 早期在 Atari 游戏上的研究。那时我们的一个问题是:我们如何把这些方法从 Pong、Space Invaders 这种小游戏,扩展到真正看起来像现实世界难题的领域?随着我们扩大这些方法的应用,相关研究也取得了很棒的进展。 Stephanie Zhan: 你知道 Sequoia 当年是 Atari 的第一个投资人吗? Max Jaderberg: 真的吗?我真不知道。这太厉害了。那些 Atari 游戏确实非常有趣,尤其在“我们已经有智能体了”这种背景下,再去玩玩 Pong 也挺好玩的。 Stephanie Zhan: Capture the Flag 和 Alpha Star 当时是令人难以置信的突破。你能聊聊这些突破到底是什么,以及你们为什么选择了这些特定的游戏吗? Max Jaderberg: 如果你想想 AI 与电子游戏的历史——为什么我们要用电子游戏?电子游戏是一种非常灵活且完全封闭的世界,研究人员和科学家可以随意操控。我们可以在其中测试不同的算法,设置不同的场景,所以它们是我们开发新算法的完美实验场。 作为强化学习研究者,你会一直思考:“我们把 Atari 破解了,接下来怎么研究更复杂的游戏?”我个人非常着迷的一点是:我希望这些智能体能够胜任任何任务。这和当时很多人训练 Atari 不太一样,通常强化学习是:定好一个游戏,训练模型直到它擅长,然后换另一个游戏,从头开始再训。但我更喜欢另一条路:我们训练出一个智能体,可以把它用到任何新任务上,而不需要再训练。要实现这一点,本质上就是让智能体在任务空间上具备泛化能力。这就需要大量的训练任务,对强化学习智能体来说,训练数据其实不是图片,不是文本,而是任务本身。 你可以想象,坐下来让整个游戏工作室手工编写数百个不同的任务和小型虚拟小游戏。我们确实做过不少这个工作。然后我们想到,可以比手工编写更进一步,用过程生成的方法自动生成各种任务和游戏,生成世界、地图和不同目标,这我们也做到了。
03. 多人和多智能体参与的游戏:驱动泛化智能的关键
Max Jaderberg: 但是你总会遇到复杂性的上限,人类能够手工设计的复杂度总是有限。这时候,多人游戏就变得非常重要了。因为一旦你从单人游戏切换到多人游戏,游戏中的不仅仅是智能体自己在玩。你还有另一个玩家或者多个玩家在场。其他玩家可以展现出很多不同的特征和行为。你面对的每一个不同的玩家、每一种不同的策略,都会从根本上改变游戏本身以及智能体要实现的目标。 我总会回想,为什么人们还会痴迷于下象棋?为什么职业棋手会一直下棋?虽然规则是一样的,但其实不一样,因为你每天都在面对完全不同的对手,而且总有新人加入,这就让游戏持续地发生变化。 多人和多智能体游戏,实际上涵盖了你可能遇到的极其多样化的任务。而 Capture the Flag,是我们首次尝试用多人游戏来真正挑战强化学习算法极限的一次探索,真正在推动我们思考怎样实现任务泛化,如何处理多智能体之间的动态关系。 Capture the Flag 是一个非常棒的突破,它真正证明了我们可以在这些多人第一人称游戏中达到人类水平的表现。
04. 从“玩具”到实际应用:通用型深度学习的迁移与成熟
Stephanie Zhan: 你在这个领域涉足得非常早。现在很多概念在大语言模型领域都非常相关。看到这些工作持续发展,你有什么感受? Max Jaderberg: 这太棒了,真的非常美好。我们早在七年前——2015、16、17、18年——就讨论过的许多核心、基础性的理念,如今在大语言模型领域被广泛应用,而且取得了当时我们只能梦想的性能,这种感觉真是令人极其满意。 Stephanie Zhan: 你曾说自己从“做玩具”转向“寻找真正的应用”。你是什么时候意识到自己找到了正确配方? Max Jaderberg: 我真的很热爱深度学习,这十几年里我一直痴迷于此。我最喜欢的一点就是,这里面有很多底层核心理念和基础积木,而这些竟然可以跨越不同应用领域之间无缝迁移。 我们2012年在计算机视觉里用的东西,在早期语言生成模型里会用到,后来在强化学习等领域仍然如此。所以我反复看到的就是:这些核心理念可以被迁移,遇到真正懂这些的人——这些人就像是“大厨”一样会用不同的积木拼出真正厉害的组合。 在当时的学术会议上,顶尖研究者会说“这还早着呢,这得十年以后”,但在你心里其实明白:我们其实已经基本攻克了。我一次又一次地见证了这种事。只要你有优秀的人才、算法、算力,针对极具挑战性的问题,往往就能找到攻克难题的“配方”。 而对我来说,我一直关注的就是这些方法的实际应用,我希望看到这些技术真正带来深远、积极的影响。所以我们现在必须进入实际应用领域,我觉得这几年正是合适的时机。 Stephanie Zhan: 你和 Demis (Isomorphic Labs CEO) 已经合作十年了,他是我们这个时代最伟大的科学家、技术专家和创业者之一。当年你还在牛津读书时他就联系了你。你创办的 Vision Factory 和 DeepMind 都在2014年前后被 Google 收购,那个之后你们开始共事,到现在已经十年了。与 Demis 的合作是什么体验? Max Jaderberg: Demis 是一个非常了不起的人,一个有思想、有个性、极具远见的人,也是非常有人情味、很容易让人产生共鸣的人,这点真的很能激励人心。和他交谈短短五分钟,就能深刻感受到他那种强烈的雄心,以及对实现这些愿景的紧迫感。 他特别擅长激发一群聪明人的能量,让大家能看到眼前之外的更远未来。我记得当我们在 DeepMind 早期办公室的大厅里,参加团队首篇《Nature》论文庆祝活动时,Demis 说:“你们知道吗,这其实只是我们几十篇 Nature 论文的开端。” 当时,这基本是第一篇登上《Nature》的机器学习论文——就是 Atari DQN 那篇。说之后还会有几十篇 Nature 论文听起来很不可思议。他甚至还补充说:“以后我们会因为这些工作拿下诺贝尔奖。”,这已经是十年前了。 他有种我称之为“rollouts mind”(预判思维)的能力,可能和他下象棋的背景有关,总是在思考未来的多步发展——现在做哪些事才能最终实现那些宏伟目标。所以,这十年来和他一起共事非常棒。现在我们在 Isomorphic Labs 依然亲密合作,雄心也从未减退。
05. 做能解决所有疾病的通用药物设计引擎
Stephanie Zhan: 关于 Isomorphic,我很想聊聊。你们现在正在开展我们这一代人中最具雄心的使命之一 “用 AI 重新构想药物发现和药物开发” 如果你们实现了 Isomorphic 的愿景,世界会变成什么样? Max Jaderberg: 在 Isomorphic,我们的愿景非常大,我们的目标是要解决所有疾病。我们正在打造的这项技术,将彻底改变我们理解生物学的方式,也会改变我们通过调控化学反应作用于生物学体系的能力。 我们真正构想的是一个未来——在那个未来里,所有疾病都能被攻克,AI 不仅帮助我们发现、创造、设计新疗法,还能让我们更深入理解我们的生物世界,搞清楚细胞如何工作、疾病的根本原因,以及由此带来的新的调控路径。 所以我们公司从创立第一天起,就是奔着这个宏伟目标去的。这不是为了某一个适应症或者某一个靶点开发疗法,而是思考如何打造一个非常通用的 AI 药物设计引擎,这不仅能用在单一靶点或单一分子类型上,还可以反复应用到任何疾病领域。现在我们正在朝着这个目标努力推进。 Stephanie Zhan: 那一开始就以“通用性”为目标,对你们实际的产品与团队建设方式有怎样的影响? Max Jaderberg: 这个问题很重要。对于当下 AI 在药物设计上的现状,很多其实还是局部模型的应用,比如有一些关于特定靶点或者某一类分子的行为数据,你就在这些数据上拟合一个小型多层感知机(MLP),做些预测,帮助你指导下一轮分子的设计。 而我们恰恰反其道而行之。从第一天起,我们就要做可以跨化学空间和跨靶点空间泛化的模型。比如像 AlphaFold 和 AlphaFold 3,就是你可以应用在完全不同类型靶标上的模型,可以用在蛋白质组中的任何蛋白质,也可以用在你想设计的任何小分子上——无需微调,无需针对每一个新应用再单独拟合本地数据。 这会彻底改变化学家、药物研发人员使用这类模型的方式——如果你每次都不需要为特定场景适配模型,效率和应用会完全不同。所以我们所有内部的研究项目——打造这个突破性的药物设计引擎,至少需要解决六个类似 AlphaFold 级别的问题,AlphaFold 只是其中的一部分。 因此,从一开始,我们就在内部设立这些研究项目,直击这六大难题。我们在 AlphaFold 和结构预测等方面当然取得了重大突破,但也在其他关键领域取得了重要进展。而且所有这些模型都具有通用性——既可以用在任何靶点上,也能覆盖不同类型的分子或多个模态。
06. 还需要6个AlphaFold级别的突破,才能实现药物研发的彻底变革
Stephanie Zhan: 这是我第一次听你说“六个 AlphaFold”。你能不能详细讲讲这是什么意思? Max Jaderberg: AlphaFold 在理解生物分子结构方面实现了巨大突破——比如蛋白质的结构,现在发展到 AlphaFold 3,可以预测蛋白质与小分子、DNA、RNA的复合结构。这是生物化学领域核心概念的一次根本性飞跃,能以实验级的准确度来获得结构信息。这为化学家的思考和分子设计工作打开了全新的大门。 我说“六个 AlphaFold”的意思,是我们还需要再有大约六个类似 AlphaFold 这样级别的突破,才能真正实现药物设计的彻底变革。 药物设计真的非常非常难。它不是单一的问题,不仅仅是理解蛋白质结构,甚至还远不止是设计一个可以以特定方式调控蛋白质的分子。你希望这个分子最终还能被做成药丸,被人体吸收,并且能够在正确的位置发挥作用,要进到细胞里,同时不能被肝脏等组织提前降解。每一个环节都是一个 AlphaFold 级别的难题,都需要突破。我们在努力攻克这些环节。 Stephanie Zhan: 很有意思。我还听你说过“药物设计的圣杯模型”和“科学代理(agent for science)”,能再解释一下你的意思吗? Max Jaderberg: 我们一直在研究的这些方向:比如分子结构与性质预测,以及这些生物分子的相互作用和随时间变化的表现,都是药物设计中的圣杯级预测难题。我们也在其中取得了很多让化学家震惊的突破,极大改变了 Isomorphic 内部的药物设计方式。 但真正值得思考的是,即便你能造出世上最好的预测模型,比如有了实验级甚至超越实验级的模型,能准确预测分子的各种属性,但是药物设计问题依然无法彻底解决。 可以这样理解:假定“药物类似物空间”约有 10 的 60 次方种(10^60)可能分子。哪怕我们借助各种条件限制,把这个数量减少到 10 的 40 次方,依然极其庞大。即使你有目前最顶级的预测模型,能筛查 10 亿个分子,也就是 10 的 9 次方,那么桌面上仍然有 10 的 31 次方个分子没被探索。 所以靠最好的预测模型,我们也只是刚刚触及了分子空间的表面。我们需要的不仅仅是“具备实验级准确度的预测模型”,还需要能够探索和导航整个 10^40、10^60 级空间的生成式模型和智能体(agent)。这些 agent 利用预测模型引导探索,但不需要穷举每一个分子。 就像 AlphaGo 无法穷举所有围棋走法,但照样能下出人类无法预见的好棋一样。分子设计其实更像围棋而不是国际象棋——后者还能靠穷举,但分子世界不可能。
07. 建立生物化学世界模型和找到药物的智能体
Max Jaderberg: 这正是生成式模型发挥作用的地方——这些智能体利用生成式模型、各种搜索技术以及强大的预测能力,真正开启了整个分子空间的探索。事实上,即便在没有 AI 的情况下,我们也能在 10^60 或 10^40 这么庞大的空间里找到药物,这让我觉得很不可思议。这表明其实这里面存在大量冗余,也有巨大的设计潜力。你想象一下,针对某种特定疾病、特定靶点,肯定存在许多不同的分子设计都能奏效,也都能成为合适的药物产品。而生成式模型和智能体的真正潜力,就在于它们能在这个空间里进行搜索,真正挖掘和发现那些潜在的优质设计。 Stephanie Zhan: 非常有意思。我用很通俗的话来理解,就是你们既在建模,也在学习和模拟这个“游戏”,同时还在努力培养出能解决不同类型“游戏”的最佳“选手”。 Max Jaderberg: 你说的没错,这正是我的思路。我们要建立自己的世界模型,建立我们对生物化学世界、生物世界的建模。但这还不够,我们还需要开发能真正探索、穿梭在这些世界里的智能体和生成式模型,帮我们在这个庞大的化学空间中找到那些改变生命的“草堆中的针”——也就是对数百万甚至上亿人都可能产生巨大影响的全新疗法。 Stephanie Zhan: AlphaFold 3 真的是突破性进展,让我们从只能预测蛋白质结构,发展到现在可以预测所有分子的结构及其相互作用。你能聊聊我们该如何看待 AlphaFold 3 在准确率、速度和效率方面的影响吗?它是否也让我们能够探索以前根本无法触及的问题空间? Max Jaderberg: AlphaFold 2 是最大的一次突破,让我们可以理解蛋白质的结构。后来还有 AlphaFold Multimer,帮助我们不仅能看懂单个蛋白质的结构,还能预测蛋白质复合物——也就是多个蛋白质如何组装在一起。这对于解答很多生物学问题提供了巨大帮助。 但如果要跳到药物设计上,这里面还有很大差距。药物设计里一个很重要的类别就是“小分子疗法”。这些分子不是蛋白质,比如咖啡因、扑热息痛等,往往可以被做成药丸服用。这些小分子疗法的原理,就是通过人体、进入细胞,然后结合在蛋白质上。蛋白质是生命的基本构建模块,它们通过彼此作用形成分子机器。 你可以想象,如果药物分子结合到某种蛋白质上,可能会干扰这两种蛋白质之间的正常相互作用,从而调节蛋白质的功能,这就是多数药物的工作机制。作为化学家或药物设计师,你需要设计出那个能精确结合到目标蛋白质、并调控其正常功能的小分子。这就需要了解这个小分子和蛋白质之间的结构关系、直接的物理绑定方式、具体的结合结构。 这正是 AlphaFold 3 诞生的重要动因。AlphaFold 3 现在不仅能够预测蛋白质的结构,还能预测蛋白质和小分子之间的结合结构,以及蛋白质和其它分子机器构件的关系,比如 DNA 或 RNA。这让我们能在分子层面结构上理解药物设计,是药物研发中的核心一环。这也打开了全新的靶点类别,比如转录因子(这些蛋白质会停留在 DNA 上读取遗传信息),你现在甚至能尝试设计小分子去改变或干预这类分子的功能。
08. AlphaFold 3对“分子-蛋白”互作与药物研发流程的质变
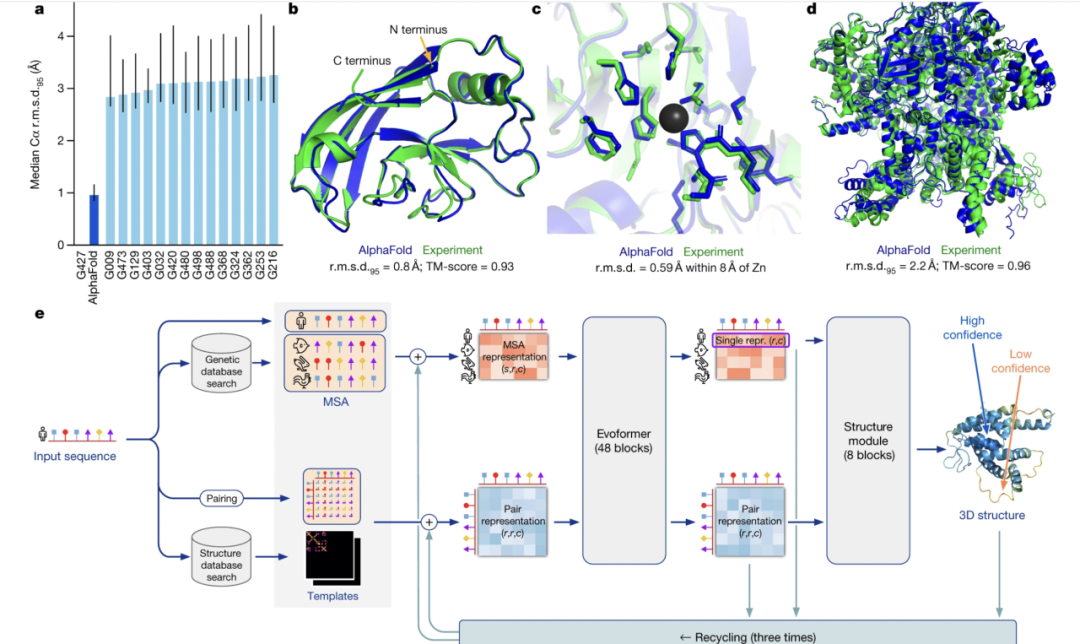
Max Jaderberg: 为了实现这一点,你真的会希望能够从三维视角“看到”所有的分子结构——如果我对自己的小分子做了改变,这些变化会如何影响它与蛋白质及整个生物分子系统的相互作用?AlphaFold 3 现在非常准确,可以让我们纯粹靠计算、靠在电脑上就回答许多过去不得不进实验室、不得不结晶分析才能得到的问题。这些实验有时耗时六个月,甚至几年,有时甚至根本做不了。而现在,在 Isomorphic,我们的药物设计师能直接在笔记本电脑、浏览器界面上理解、修改自己的分子设计,并马上看到这些变化的影响。 Stephanie Zhan: 所以 AlphaFold 3 目前关注的分子间相互作用包括:蛋白质和核酸、蛋白质和配体、抗体与抗原。能否举个例子,说明 AlphaFold 3 在这些不同蛋白和分子作用上的影响? Max Jaderberg: 蛋白质和配体就是蛋白质和小分子,这两个词是同义的。此外还有蛋白质与蛋白质间的相互作用,还有一大类叫做“生物药”的疗法,比如抗体药物。这样我们不仅能理解抗体和目标蛋白的相互作用,还能打开很多新疗法模态,这本身也涵盖了抗体—抗原的结合界面。所以,无论是哪个应用领域,其实都是用同样的模型进行分析。 Stephanie Zhan: 像 AlphaFold 3 这样的模型训练有什么特殊难点,使用扩散模型架构又有什么好处? Max Jaderberg: 这是个好问题。为了把 AlphaFold 3 做出来,我们确实要克服很多挑战。最有趣的部分之一是:最初 AlphaFold 只能处理蛋白质结构,但我们希望引入全新的模态——DNA、RNA、小分子等数据类型。蛋白质怎么“分词”我们已经有经验了,但要如何“分词”DNA和小分子呢? 对于 DNA/RNA,分词方案较直接,比如按碱基分。但小分子就需要尝试各种不同方式,最后发现按原子分辨率进行分词效果最好。 接下来就是:如何预测这些不同类型分子的混合结构?用 AlphaFold 2 的结构已不适用了。这是扩散模型闪光的地方:我们可以原子级地为每个原子建模、预测三维坐标,扩散模型直接输出每个原子的3D坐标。而刚才说的分词方式,是在推断过程中对扩散模型进行条件约束。 这一点带来了极大突破,尤其是在小分子—蛋白质结合预测准确率上,也为整个项目后续发展扫清了障碍。 Stephanie Zhan: 数据、算力和算法——这是所有相关领域都关键的三要素。但我看到 Demis 的采访时挺惊讶——他说生物领域并不数据受限。你怎么看这个说法? Max Jaderberg: 我认为,在任何一个机器学习方向,其实你都会感受到数据的约束。但 Demis 说的重点是,这并不是整个领域的真正瓶颈。就是说我们其实能用现在已有的数据,也能自己生成新数据,做出真正的进展。我们不需要等上几十年世界再收集数据,我们就能取得突破,事实上我们也的确做到了。 有些建模空间,那些数据也许其实早已存在,结果是我们在这些领域里真的能把水平带到前所未有的新高度。这并不代表生物领域的数据未来就不重要了,相反,随着这些模型和系统的推进,数据反而会变得更关键。 更重要的是:用于机器学习的生物数据,其实还没有真的被创造出来。现在有大量历史数据,但那些历史数据其实不是为机器学习模型准备的。如果考虑如何为模型训练来创造数据,这种思路和以往完全不同,值得深入探索。 Stephanie Zhan: 你觉得我们现在还缺少哪类数据?你认为我们对合成数据(synthetic data)有需求吗? Max Jaderberg: 我本人是合成数据的超级支持者。其实职业生涯早期也是靠合成数据“起步”的,因为当时作为博士生,我只有几千张图片可用,谷歌却能拿到几百万,所以干脆自己大量生成合成数据,做出突破。 在化学领域也是类似。理论基础很扎实,我们对物理、量子化学、量子力学都很懂,可以基于这些原理开发模拟器,再对经典的分子动力学过程做可扩展的近似。这类模拟就能生成一大堆合成数据。再者,生成式模型本身也可以生成新数据,还可以用各种打分机制,进一步提升信息含量。 但我认为有一块“开放区间”还未被攻占,那就是所谓的“体内数据”(in vivo data)——就是本该在动物(比如老鼠、大鼠)身上获得的数据。目前有些历史体内数据,但我们没法大量新生成。这里很有可能依赖全新的数据生成技术,比如芯片上的类器官(organoids on a chip),让你能获得以前只能靠动物实验才能测到的数据。 在生物和化学领域的数据生成技术还将迎来全新突破,这也会极大重塑我们的建模思路。
09. AI如何正在重塑药物设计和开发流程
Stephanie Zhan: 你们在公司内部是否在开发“体内数据”的相关项目,还是希望其他公司来填补这方面的空白? Max Jaderberg: 其实我们在Isomorphic内部没有专门的实验室,但我们与许多其他公司合作。我们自己也生成了大量数据,很多都是专有数据。我们已经看到这些数据产生了令人惊讶的影响。 Stephanie Zhan: 这很有道理。有人认为,模拟分子的结构、功能及其功能调节非常重要,但在药物开发中,这些并不总是限制性因素。你怎么看? Max Jaderberg 正如我之前提到的,药物设计确实非常复杂。甚至在进入药物开发,也就是把这些设计实际用于临床试验之前,在整个设计和开发过程中已经存在许多瓶颈。 药物开发指的是我们如何开展临床试验、如何在人体中测试这些药物、怎样既高效又安全地推进。这里面有许多瓶颈,我认为整个行业需要共同努力创新,尤其是随着我们对这些分子与人体相互作用和毒性预测模型的不断提升,我们也必须改变对临床试验的思考方式,真正利用这些进步,最终让患者尽早获得紧缺的治疗手段。 即使是在分子本身的设计阶段,我们也不只是要了解分子的结构,也不只是了解分子如何改变某种蛋白质的功能。我们实际上要理解这些分子会如何影响我们体内几乎每一种蛋白,因为当你作为药片服用时,它会作用到全身。而这正是毒性的主要原因——你可能设计出了一个对靶点特别有效的分子,但它也会影响到其他东西。当然,你会做大量筛选来规避这些问题,但能预测得越多越好。 从我的视角看,一个令人兴奋的事情在于,如果我们可以训练出理解分子与特定靶点相互作用的一般性模型,为什么不能用同一模型去理解这些分子与身体其它所有靶点的作用呢? Stephanie Zhan 那现在AlphaFold 3对药物设计者来说,有什么新可能?你们内部如何使用它? Max Jaderberg AlphaFold 3为我们的药物设计师提供了一种能力,可以理解他们的分子设计到底是如何与疾病靶点蛋白相互作用的。药物设计师可以不断调整分子设计,并立即看到这些变化会如何影响分子与蛋白之间的物理作用,这非常强大。 在AlphaFold 3出现之前,你甚至可能完全不知道你的分子是怎样与蛋白结合的,只能凭直觉。也许在药物设计流程中某个时候,你能拿到某个设计的三维结构,但那是需要到真实实验室里去做结晶,如果顺利的话也要六个月才能拿到的结构数据,而且这仅仅是某一个设计,而不是你每次微调之后都能看到完整结构。 所以AlphaFold 3彻底改变了化学家平时的设计方式。不过我要强调,这还远远不是我们的终点,因为我们不仅想知道这些分子和蛋白质的结合长什么样,我们还想知道结合的强度、分子的其它特性、分子结合对蛋白结构和功能的变化,以及最后对细胞动力学的影响。这里面有太多科学问题,这也正是我们正在攻克的AlphaFold式的下一个突破点——为化学家赋能,深度融入分子设计流程。 Stephanie Zhan: 有意思。那你们现在内部确实在设计一些药物,主要关注哪些靶点和项目? Max Jaderberg: 我们内部的药物设计项目非常令人兴奋,重点聚焦在免疫学和肿瘤学方向。这些领域我们已经取得了重要进展,尤其是在机器学习模型彻底改变药物设计流程方面,这是非常令人激动的。 Stephanie Zhan: 你们也与礼来和诺华合作,近期还扩大了与诺华的合作,可以具体说说这些合作都在做什么吗? Max Jaderberg: 我们签了两份关键合作协议,一份跟礼来,一份跟诺华,非常棒。他们给我们带来了非常有挑战性的科学问题。比如诺华给我们的靶点,是该领域和诺华自己十年以上都还在攻克的难题。不是那种“尝试一下看看”的问题,都是十足的“硬骨头”。 去年我们的内部和合作项目都极为成功,看到模型在这些难题上的表现让人非常兴奋。我们找到了新的化学实体,探索出调节这些老靶点的新方法,看到了合作拓展的原因。这应该也是对我们成效的最好肯定。 Stephanie Zhan: 我想聊聊团队搭建。你们集结了顶尖人才,包括AI、化学、生物领域的专家,还引入了“外行”来质疑传统。你是怎么思考团队建设的? Max Jaderberg: AI+药物设计这个领域其实没存在多少年。所以你很难找到一个在药物设计上是世界顶尖、同时又是机器学习/深度学习世界顶尖的人才。因为这两个领域共生时间太短了,基本不存在这样的人。 我由衷认为,我们实际上正在孕育一个新学科,因为我们将这些处于交叉点的专家聚到了一起。既然聘不到这样的人,那就把药物设计和药物化学的世界级专家、再把机器学习和深度学习的世界级专家请进来,让他们并肩共事。 而且,光让这些顶尖人才各自呆在自己的小团队里也远远不够。你需要让这些不同背景的人真正坐在一起,互相学习彼此的语言,互相保持好奇和同理心,一起探索新的科学直觉。 我们已经亲眼看到了一些非常惊人的协作现象,比如一个不懂化学生物的“通用型”机器学习专家,在融入药物化学和药物设计师的思维题后,迸发出了创新的活力。
10. 生物化学领域的GPT3时刻
Max Jaderberg: 在招募机器学习科学家和工程师时,其实我们团队里有60%到80%的人在加入前对化学或生物基本没有了解,可能只有高中或大学层面知识。实际上这反而成了一种优势,因为带着点“天真”的心态进入这个领域。 关键在于好奇心——我认为好奇地提问题,即使是那些听起来“愚蠢”的问题,是非常重要的。正因为这样,我们能够从第一性原理出发,甚至可以打破以往的经验主义和传统做法,从零开始以全新视角思考问题。这也是我们取得诸多研究突破的核心思路。 Stephanie Zhan: 去年11月你们也做了一个大动作,发布了AlphaFold服务器,开放了代码和模型权重供学术使用。能谈谈为什么这样做吗? Max Jaderberg: AlphaFold一直秉承为学术和科学用途开放的传统。这次AlphaFold 3的重要突破,我们认为必须让科学界能够免费获得这项功能。因为AlphaFold 3对于药物设计非常有用(已经产生巨大作用),但同样对基础生物学和理解生物学的很多其他领域也非常宝贵。 事实上,科学家们正在用我们的AlphaFold 3服务器和模型做出极具创造性的探索。所以给非商业、学术方向免费用,这是我们非常重视的事情。看着服务器被积极广泛地使用,真的很令人振奋。 Stephanie Zhan: 聊聊未来吧。你能预告一下AlphaFold接下来会有怎样的方向吗? Max Jaderberg: 以结构预测这个问题来说,我希望这项技术能被完全解决。AlphaFold 3无疑是一个巨大、关键的突破,但还不是100%准确。到底什么才算100%准确呢? 就像很多科学领域一样,随着你不断推动边界,会发现每解开一个问题,就会冒出更多新的难题。这也是科学迷人之处吧。 以AlphaFold 3为例,当我们获得这些能力时,也会发现还有更深层的问题需要研究。继续提高结构预测的准确率始终是我们的追求,但不仅仅是静态结构。现在的AlphaFold 3主要是在模拟这些几乎“静止、结晶态”的分子结构及其相互作用。但现实世界中分子都是处于溶液、不断运动和变化的。 所以,如果未来能搞懂这些体系的动力学变化,也会非常有意思。 Stephanie Zhan: 那你觉得人工智能生物学领域的“GPT-3时刻”会是什么样的?什么时候会到来? Max Jaderberg: 如果说GPT-3的意义,本质上是一个生成式模型。以前的文本生成模型虽然能生成些东西,看起来像文字,但总觉得不像人写的。直到GPT-3,才真的让人有“这好像人写的”感觉。它真正学到了训练数据的分布,能还原数据本身的“流形”。 类似地,在生物学领域,一旦生成式模型能模拟现实世界中会真实存在的结构,这就特别令人兴奋。因为就代表模型不仅能吐出已经存在的分子,甚至可能生成人类未见过但在现实世界里可以稳定存在的新分子、新材料,甚至新药物。 而且相比语言(语言生成我们人类能直接判断),化学和生物的复杂度更高,人类本身都难以完全理解。 所以那个“GPT-3时刻”,在生物医药领域的表现,可能不会像GPT-3那样更像人,而更像AlphaGo对李世乭的“第37步”——模型做出超越人类理解但在现实中成功的创造。这会颠覆很多既有认知。我们内部现在已经遇到一些情况,比如生成模型给出的新药设计被人类设计师质疑,结果真实测试模型才是正确的。 Stephanie Zhan: 这个类比太妙了,“第37步”时刻意味着模型展现出创造力超越人类。 Max Jaderberg: 完全是。第37步,是AlphaGo与李世乭世纪对决中的一手神来之笔。当时全世界棋手没人看懂,以为是失误,但事实证明这是决胜招。这种超越人类理解,却又真实、正确的创造力,未来会越来越多出现在化学、生物等领域的AI模型中。 Stephanie Zhan: 那什么时候能看到第一款AI设计的药物进入临床,走到一、二、三期试验? Max Jaderberg: 我们的药物设计项目进展非常迅速。令我关注的是,随着越来越多AI设计的新药分子进入临床流程,我们该如何参与和推进临床开发,尽快、尽可能安全地将这些分子推向有急需病人。 这意味着我们需要探索和监管机构新的合作方式,也要将我们强大的预测模型纳入到药物如何全身作用、潜在毒性的考量中。 未来可以有更多优化,加快新药上市流程,甚至可能会彻底改变我们对临床试验的传统理解——比如借助AI,药物设计会更快、更有针对性,相关知识积累也会更高效。这一定会改变行业格局,但要真正实现还需要全行业的共同努力。 Stephanie Zhan: 最后一个问题:如果Isomorphic成功了,乃至整个领域都成功,传统制药行业会发生什么? Max Jaderberg: 我觉得,最终整个制药行业都会使用AI。根本不存在五年后还有不用AI做药物开发的情况。就像现在没人会不用数学做科学一样,AI会成为生物、化学最基础的核心工具。在Isomorphic,我们已经这样做了,将来整个行业都会全面接纳AI。到那时候,不是“传统制药”对“AI制药”,而是这两个概念彻底融合,整个行业都会转向AI驱动。


关注公众号
即时获知最新推送
休闲时刻
陶冶艺术情操
Copyright © 2015 Science And Technology Investment Network.All Rights Reserved 版权所有:数智化网
地址:北京市海淀区翠微中里14号楼
